Ruolo del digiuno
Il DIGIUNO favorisce la produzione di ormoni catabolici: il glucagone nel pancreas, l’epinefrina e il cortisolo nelle ghiandole surrenali. Questi ormoni agiscono su diversi organi:
Entrambi innescano la glicogenolisi (demolizione del glicogeno in molecole di glucosio) nel fegato e nei muscoli; il risultato sarà il rilascio del glucosio nel circolo ematico.
Questi ormoni avviano anche la lipolisi (degradazione dei grassi corporei) che fornisce acidi grassi; questi ultimi entrano nei mitocondri e vengono ossidati ad acetilCoA.
Possiamo definire il fegato normalmente come un organo chetogenico perché converte l’acetilCoA in corpi chetonici come il beta-idrossibutirrato (BHB).
Le CELLULE TUMORALI e il loro Nutrimento
Le cellule tumorali presentano due punti in cui la glicolisi, cioè la via di produzione dell’energia a partire dal glucosio, risulta bloccata.
Per superare il “primo collo di bottiglia” le cellule tumorali devono incorporare molto più glucosio per trarre energia dalla glicolisi.
Il “secondo collo di bottiglia” si ha nella fase iniziale del ciclo di Krebs (ciclo metabolico che trasforma in energia i nutrienti assunti con la dieta), questo determina la produzione di acido lattico, anche in presenza di ossigeno (effetto Warburg). La fuoriuscita dell’acido lattico dalla cellula favorisce la sintesi di NAD+ (molecola che permette il trasferimento di elettroni durante le reazioni di ossidoriduzione) necessario perché la glicolisi possa andare avanti, per la produzione di ATP e per la sopravvivenza complessiva del tumore.
Di contro un aumento dell’acido lattico all’interno delle cellule tumorali induce stress ossidativo e, presumibilmente, acidificazione intracellulare, che inibisce la progressione del tumore.
Nei mitocondri delle cellule tumorali l’accumulo del citrato che avvia il ciclo di Krebs aumenta; questo alimenterà la sintesi degli acidi grassi e dei lipidi necessari per formare nuove membrane per le cellule tumorali mitotiche:
Per i due blocchi visti in precedenza, le cellule tumorali devono utilizzare i chetoni per creare il loro AcetilCoA mitocondriale, attraverso la chetolisi, cioè la scissione dei corpi chetonici che permette di aumentare la concentrazione del citrato.
Tra i corpi chetonici, il beta-idrossibutirrato (BHB) ha un ruolo chiave nel preservare l’acetilazione degli istoni (proteine associate al DNA) ed indurre così l’espressione di geni fetali.
una maggiore presenza di questo chetone indurrebbe l’espressione di proteine fetali: questo effetto epigenetico determina un fenotipo di “cellule staminali” in cui le cellule mitotiche (che si moltiplicano) non riescono a differenziarsi.
Diminuire la concentrazione di BHB farebbe morire di fame le cellule tumorali: gli istoni sarebbero deacetilati e ciò favorirebbe l’espressione delle proteine adulte, la differenziazione cellulare e sarebbe possibile l’apoptosi (morte programmata) delle cellule tumorali.
Questo permetterebbe inoltre di rallentare l’accumulo del citrato all’interno della cellula, comprometterebbe anche la sintesi dei grassi e quindi di nuove membrane delle cellule mitotiche.
Keto Diet Si o NO?
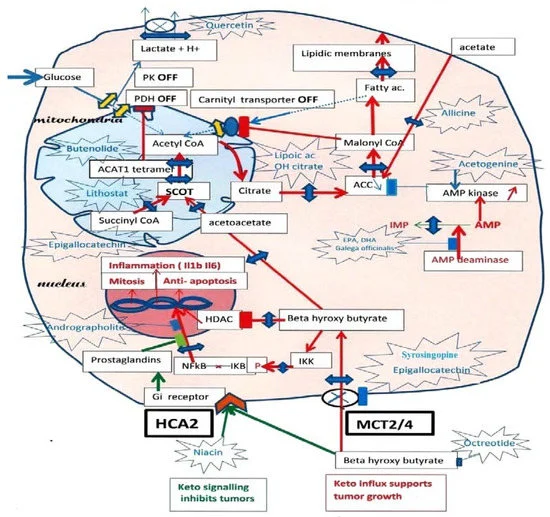
Un tumore chetolitico-dipendente crescerà se alimentato con BHB, pertanto, le diete chetogeniche-che favoriscono la produzione di questo chetone-potrebbero essere inappropriate. Altre osservazioni mostrano che invece i chetoni a digiuno sarebbero utili, il che, tuttavia, potrebbe non essere il caso delle diete chetogeniche ad alto contenuto di grassi. Questo merita una spiegazione.
È stato dimostrato che gli acidi grassi saturi a 16 o più atomi di carbonio o quelli trans-insaturi abbinati a diete ricche di grassi, potenziano la via lipogenica: si verifica un aumento della chetolisi per produrre l’acetil-CoA e il citrato necessari. L’aumento della lipogenesi supporterà quindi la sintesi delle membrane lipidiche per le cellule mitotiche.
Durante il digiuno, questa spinta lipogenica da parte degli acidi grassi saturi non si verifica.
Al contrario, gli acidi grassi insaturi, come l’acido docosaesaenoico (DHA), inibiscono la lipogenesi, compromettendo la formazione di nuove membrane.
Supponiamo che si inibisca la via chetolitica, diminuendo ad esempio la concentrazione di BHB intracellulare: il tumore dovrebbe morire di fame. Inoltre, ci sono osservazioni che indicano che la diminuzione di questo chetone intracellulare interrompa l’infiammazione, come pure il suo aumento a livello extracellulare.
Questo potrebbe spiegare le osservazioni opposte sugli effetti del BHB sui tumori.
CONCLUSIONI
Una caratteristica comune dei tumori è quella di acquisire sostanze nutritive, nonostante le loro specifiche alterazioni metaboliche, e costruire la loro biomassa.
Le cellule tumorali hanno difficoltà ad utilizzare la fonte glicolitica dell’acetil-CoA, inoltre, il secondo collo di bottiglia (presente nella fase iniziale del ciclo di Krebs) le spinge ad aumentare l’afflusso di glucosio fermentato in acido lattico. Esse devono sintetizzare gli acidi grassi necessari per le loro membrane lipidiche mitotiche; questo processo inibisce automaticamente la degradazione degli acidi grassi in acetil-CoA mitocondriale e le rende dipendenti dai corpi chetonici per produrlo.
Il lato oscuro della chetolisi è la nutrizione e la crescita dei tumori, un effetto opposto a un’azione benefica di segnalazione dei chetoni, che porta a risultati contraddittori sull’effetto dei chetoni nella ricerca sul cancro: questo è il paradosso delle dieto cheto.
Le peculiarità del metabolismo delle cellule tumorali che potrebbero essere sfruttate per il trattamento del cancro sono state discusse in lavori che prendono in considerazione le vie di trasmissione dei segnali con cui le cellule comunicano tra loro e la riprogrammazione metabolica tipica delle cellule tumorali stesse.
Non sarà pertanto sufficiente un singolo composto a sviluppare un trattamento metabolico; la strategia sarà quella di attaccare ogni fase del processo chetolitico. Ciò farebbe gradualmente morire di fame il tumore, rispetto agli altri tessuti, perché, a differenza delle cellule sane, i tumori dipendono in particolare dall’apporto chetogenico per il loro metabolismo.
Israël, M.; Berg, E.; Tenenbaum, G. Cancer Metabolism: Fasting Reset, the Keto-Paradox and Drugs for Undoing. J. Clin. Med. 2023, 12, 1589. https://doi.org/10.3390/jcm12041589

